توضیحات
دید کلی
در شیمی معدنی ترکیباتی وجود دارند که در آن اتم مرکزی حداقل با یک پیوند داتیو با گروه اتمهای اطراف خود (لیگندها) ارتباط برقرار میکند. در این ترکیبات اتم مرکزی گیرنده جفت الکترون میباشد، چنین ترکیباتی را کمپلکس یا ترکیبات کئوردیناسیونی مینامند. اتم مرکزی در این ترکیبات معمولاً دارای یک حفره الکترونی میباشد که میتواند الکترونهای جفت نشده لیگند را بگیرد و یک پیوند کووالانسی-کئوردیناسیونی ، (داتیو) تشکیل دهد.
کمپلکسهایی که در آنها انتقال الکترون میتواند در تشکیل پیوند نقش بسزایی داشته باشد کمپلکسهای دهنده – گیرنده مینامند. اکثر عناصر جدول تناوبی اعم از فلزات گروه اصلی ، فلزات گروه واسطه و غیر فلزات میتوانند کمپلکس تشکیل دهند.
تاریخچه
تا سال 1913 ساختمان کمپلکسها مشخص نشده بود اما در این سال آلفرد ورنر پدر شیمی کوئوردیناسیونی نظر خود را در مورد ساختمان کمپلکسها اعلام کرد و این در حالی بود که هنوز ساختمان الکترونی اتم مشخص نشده بود. قبل از ورنر دانشمندی به نام یورگنسون برای برخی از کمپلکسها ساختارهایی تعیین کرده بود که با اعلام نظریه ورنر اشتباه بودن این ساختارها مشخص شد.
ورنر به دلیل مطالعاتی که روی کمپلکسهای هشت وجهی ، مسطح مربعی و چهار وجهی انجام داد و بنیانگذار شیمی کوئوردیناسیون شد، جایزه نوبل شیمی را در سال 1913 دریافت کرد.
نظریه ورنر
هر اتم دارای دو ظرفیت میباشد. ظرفیت اصلی و ظرفیت والانس فرعی ، بنابراین لزومی ندارد که فقط به اندازه ظرفیت اصلی یک اتم ، اتمهای دیگر به آن وصل شود بلکه بعد از پر شدن ظرفیت اصلی که فضای کئوردیناسیونی داخلی را تشکیل میدهد. اتمها میتوانند به ظرفیت فرعی یا فضای کئوردیناسیون خارجی که نشانگر عدد اکسیداسیون اتم مرکزی است، وارد شوند.
تا قبل از اینکه ورنر این نظریه را اعلام کند دانشمندان در تعیین ساختمان ترکیباتی مانند 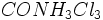
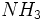
عکس پیدا نشد
اما ورنر این ترکیب را یک یک ساختمان هشت وجهی پیشنهاد کرد که اتم کبالت در مرکز و 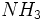
لیگند
دستهای از اتمها که باهم هستند و یکی از اتمها میتواند جفت الکترونش را در اختیار اتم دیگر قرار دهد. لیگند ممکن است یک ترکیب خنثی یا یک آنیون باشد.
انواع کمپلکس
کمپلکسهای ورنر یا کلاسیک
ترکیبات کوئوردیناسیونی که در آنها فلز مرکزی با حالت اکسایش +2 یا بالاتر توسط اتمهای غیرکربن کئوردینه شدهاند کمپلکسهای ورنر یا کلاسیک نامیده میشوند (این نامگذاری به خاطر مطالعات ورنر در شیمی کئوردیناسیون انجام شده است.).
کمپلکسهای آلی فلزی
در این کمپلکسها فلز مستقیماً با کربن پیوند تشکیل میدهد. در این ترکیبات فلز در حالت اکسایش پایین خود مانند 2- و 1- و 0 و 1+ میباشد.
کمپلکسهای کلاستر یا خوشهای
در این ترکیبات اتم مرکزی گروهی از فلزات میباشند که باهم پیوند تشکیل دادهاند. مانند 
عدد کوئوردیناسیون
تعداد اتمهایی که اتم مرکزی را در اولین قشر کئوردیناسیون ، کئوردینه کردهاند عدد کئوردیناسیون میگویند. عدد کئوردیناسیون هر ترکیب مشخص کننده ساختمان آن ترکیب میباشد. رایجترین عدد کئوردیناسیون در کمپلکسها عدد 6 و بعد از آن 4 میباشد.
عوامل مؤثر درتشکیل کمپلکس
- لیگند مهمترین عامل در تشکیل کمپلکس میباشد. نوع لیگند ، اندازه لیگند و تعداد لیگند در پایداری کمپلکسها تأثیر فراوان دارد.
- عامل دوم در تشکیل کمپلکس نوع فلز مرکزی میباشد.
انواع لیگند
- لیگندهای یک دندانه:فقط دارای یک اتم کئوردینه کننده است. هالیدها ، نیترات ، انواع آمینها ، سولفات و از مهمترین لیگندهای یک دندانه هستند.
- لیگندهای چند دندانه:این لیگندها دارای یک یا چند اتم کئوردینه کننده هستند. این لیگندها کمپلکسهای پایدارتری ایجاد میکنند و به کی سیلت یا شلاته کنندهها معروفند. یک کمپلکس میتواند به صورت آنیونی ، کاتیونی یا خنثی باشد.
فهرست مطالب:
معرفی ترکيبات کوئورديناسيون
ويژگيهای ترکيبات کوئورديناسيون
انواع لیگندها
لیگندهای تک دندانه
لیگندهای چند دندانه
لیگندهای پل ساز
ليگندهای دوسر دندانه ای
و…
نظريه زنجيره ای بلومستراند- يورگنسن
نظريه ورنر
داده های مربوط به هدايت سنجی در کمپلکس های کبالت
معايب نظريه ورنر
نظريه کوئوريناسيون سيجويک
کمپلکسهايی که از قاعده عدد اتمی موثر تبعيت می کنند
کمپلکسهايی که از قاعده عدد اتمی موثر تبعيت نمی کنند
معايب نظريه کوئوريناسيون سيجويک
نظريه پيوند ظرفيتی
انواع هيبريدها در کمپلکسهای فلزی
ممان مغناطيسی اسپينی
تعيين شکل هندسی کمپلکس با استفاده از ممان مغناطيسی اسپينی
معايب نظريه پيوند ظرفيتی
نظريه ميدان بلور
الگوی شکافتگی اوربيتالهای d در کمپلکس های هشت وجهی
نحوه شکافتگی اوربيتالهای d در کمپلکس های مسطح مربعی
دلايل کوچکتر بودن Δt از Δo
اندازه گيری Δo
نحوه انتقال الکترونی در کمپلکس +Ti3
تعيين انرژی پايداری ميدان بلور
عوامل موثر بر ميزان Δ
سری اسپکتروشيميايی
شواهد تجربی شکافتگی اوربيتال های d
نتایج
شناسايی ساختارهای اسپينل و آنتی اسپينل
مزايای نظريه ميدان بلور
معايب نظريه ميدان بلور
استقرار الکترونها در اوربيتالهای d در کمپلکسهای هشت وجهی
اثر قدرت ميدان بلور بر روی رنگ کمپلکس ها
اثر يان- تلر
شواهد تجربی برای انحراف يان تلر
نظريه اربيتال مولکولی
تشکيل پيوند π
شواهد تجربی تشکيل اوربيتالهای مولکولی
و…
پايداری ترموديناميکی و سينتيکی
ثابت های پايداری
رابطه ميان ثابت های پايداری مرحله ای و ثابت مرحله ای کل
مقايسه ثابتهای پايداری متوالی
عوامل موثر در کاهش تدريجی ثابت های پايداری
انواع يونهای فلزی بر اساس پايداری کمپلکس
و…
کاربردهای ترکيبات کوئورديناسيون
کاربرد کمپلکس های فلزی در تجزيه کيفی معدنی
کاربرد کمپلکس های فلزی در تيتراسيون کمپلکسومتری
کاربرد کمپلکس های فلزی در وزن سنجی
کاربرد کمپلکس های فلزی در پايدار سازی حالت های اکسايش
و…
- لینک دانلود فایل بلافاصله بعد از پرداخت وجه به نمایش در خواهد آمد.
- همچنین لینک دانلود به ایمیل شما ارسال خواهد شد به همین دلیل ایمیل خود را به دقت وارد نمایید.
- ممکن است ایمیل ارسالی به پوشه اسپم یا Bulk ایمیل شما ارسال شده باشد.
- در صورتی که به هر دلیلی موفق به دانلود فایل مورد نظر نشدید با ما تماس بگیرید.
 مرجع دانلود فایل | مرجع دانلود فایل
مرجع دانلود فایل | مرجع دانلود فایل


هنوز هیچ نقد و بررسی وجود ندارد.